1 AlphaFold 3是什么?
AlphaFold 3是谷歌DeepMind与Isomorphic Labs于2024年5月联合开发的革命性生物分子结构预测人工智能模型,作为AlphaFold系列的最新版本,它首次突破了单一蛋白质结构预测的限制,能够预测几乎所有生命分子的三维结构及其复杂相互作用,包括蛋白质、DNA、RNA、配体、离子和化学修饰等。
这一模型的核心创新在于采用了条件扩散预测方法,直接从原子云开始通过多轮迭代细化生成精确的分子结构,替代了前代产品中的几何参数化方法。AlphaFold 3的预测成功率显著优于传统对接方法,在未知口袋的配体结合预测准确率达76.4%,蛋白质与DNA结合预测成功率65%(传统方法仅28%),抗体-抗原复合物预测准确率62%(是传统方法的两倍)。
AlphaFold 3于2024年11月11日完成开源,同时推出的AlphaFold Server免费平台将每日使用限制提升至20次,支持全球科学家进行非商业研究,为药物研发、酶工程和基础生物学研究提供了前所未有的工具支持。
AlphaFold 3核心功能快览
AlphaFold 3是谷歌DeepMind与Isomorphic Labs联合开发的第三代生物分子结构预测AI模型,基于扩散模型和Pairformer架构,可预测蛋白质、DNA、RNA、配体等几乎所有生物分子的三维结构及相互作用,准确性比传统方法提高50%以上,并通过免费服务器平台向全球研究人员开放。
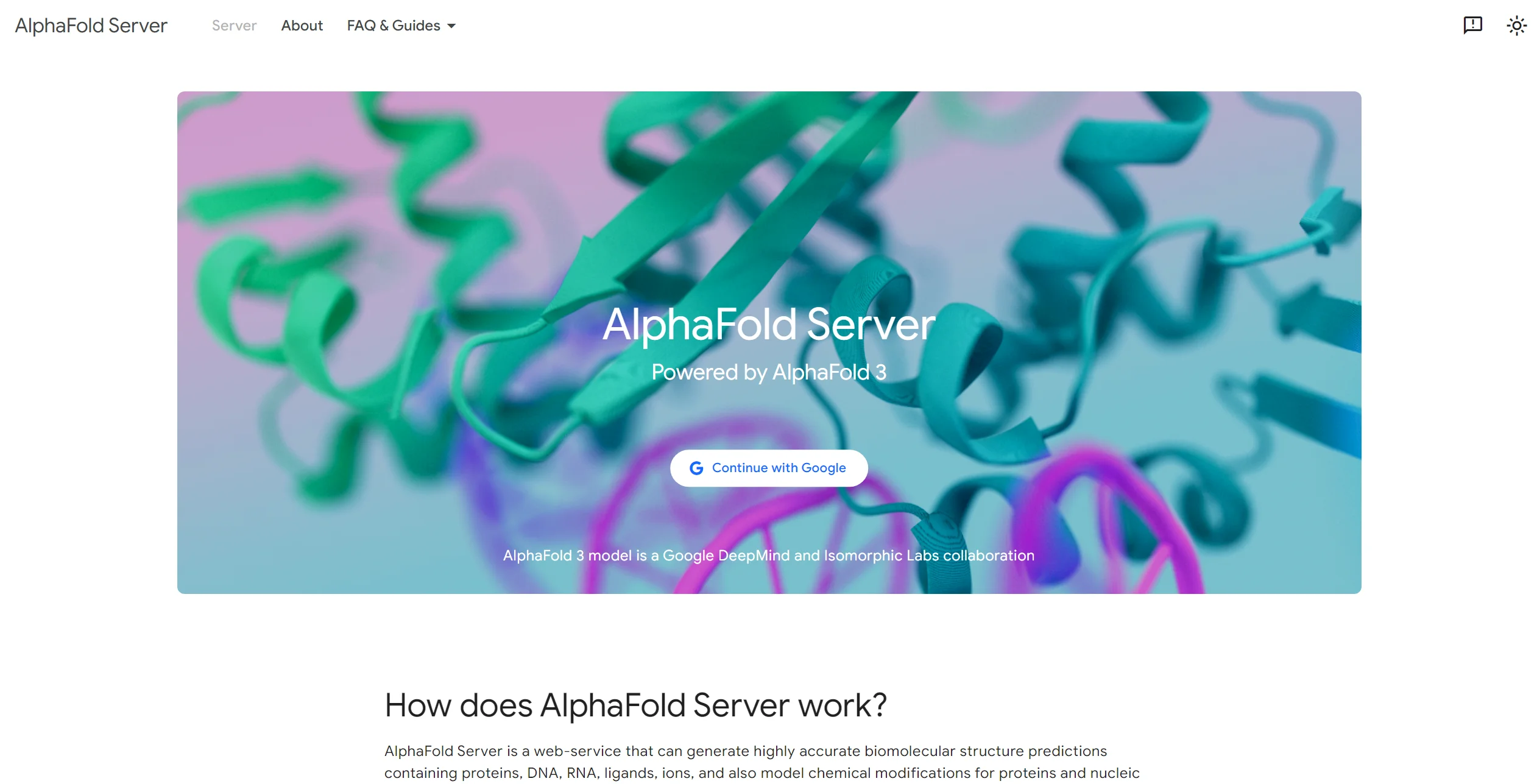
产品关键信息列表
| 项目 | 详细信息 |
|---|---|
| 开发公司 | Google DeepMind与Isomorphic Labs |
| 发布时间 | 2024年5月8日通过《自然》期刊首次发布 |
| 最新版本 | AlphaFold 3(2024年11月开源) |
| 主要功能 | 预测蛋白质、DNA、RNA、配体等生物分子的三维结构及相互作用 |
| 技术基础 | 扩散模块+Pairformer架构,减少对多序列比对(MSA)的依赖 |
| 官方平台 | AlphaFold Server (https://alphafoldserver.com) |
| 使用限制 | 非商业研究每日20次预测 |
| 准确性提升 | 比传统方法提高50%-100% |
2 AlphaFold 3的主要功能和特点
2.1 技术创新与架构优势
AlphaFold 3的核心突破源自其全新的深度学习架构,该架构巧妙融合了多种先进技术。模型采用升级版Evoformer模块优化了进化信息处理,同时引入全新的扩散网络(Diffusion Network),类似于AI图像生成器中的扩散过程,从原子云开始通过多轮迭代细化,最终汇聚成精确的分子结构。此外,简化的Pairformer模块替代了AlphaFold 2中的复杂方法,更高效准确地预测各种分子类型。
与AlphaFold 2相比,AlphaFold 3在架构上实现了三大革新:MSA处理的简化使计算复杂度显著降低;结构生成方式的革新通过扩散模型直接预测原子坐标,无需中间参数化步骤;化学约束处理方式的改进通过扩散模型的多尺度特性隐式学习立体化学约束,而非依赖显式损失函数。这些改进使AlphaFold 3能够更自然地处理各种非标准结构和化学组分,成为真正的多分子结构预测工具。
2.2 多分子预测能力扩展
AlphaFold 3最显著的突破是将预测范围从单一蛋白质扩展到几乎所有的生命分子类型。它能够准确预测蛋白质与DNA、RNA的相互作用,为基因调控机制研究提供关键工具;可模拟小分子配体与靶蛋白的结合方式,直接支持药物设计;还能处理离子环境和各种化学修饰对分子结构的影响,全面模拟真实生物环境中的分子行为。
在预测能力方面,AlphaFold 3在多项基准测试中表现卓越。在PoseBusters基准测试中,它无需借助结构信息输入就超越了当前最佳的物理学方法,成为首个在生物分子结构预测上胜过物理模型的AI系统。特别是在预测类药分子与蛋白质结合方面,AlphaFold 3展现出非凡表现,为抗体药物设计和优化提供了原子级精度的指导。
2.3 精度与速度的双重提升
AlphaFold 3不仅在预测范围上大幅扩展,在预测精度和速度方面也实现了显著提升。研究表明,与现有的预测技术相比,AlphaFold 3在蛋白质与其他分子类型的相互作用预测上至少提高50%的准确性,并在某些关键的相互作用类别上实现精度翻倍。例如,在蛋白质与DNA结合预测中,AlphaFold 3的成功率达到65%,而传统技术只有28%;在抗体-抗原复合物预测中,准确率达到62%,是传统方法的两倍。
令人惊讶的是,尽管功能更加强大,AlphaFold 3的运行速度反而比AlphaFold 2明显提高。这一方面得益于模型架构的优化(如用Pairformer替代复杂的Evoformer),另一方面可能由于谷歌提供了更强的算力支持。研究人员过去需要数年时间才能确定的分子结构,现在通过AlphaFold 3只需几分钟就能获得高质量预测,极大加速了科学研究进程。
3 如何使用AlphaFold 3?
3.1 访问与准备工作
AlphaFold 3主要通过AlphaFold Server在线平台提供服务,该平台为全球研究人员提供免费、易用的非商业研究工具。访问官方网站https://alphafoldserver.com后,用户需要使用Google账号登录。平台支持两种输入方式:一是手动填写每个任务的参数,适合单次预测;二是上传.json格式的批量任务配置,更适合大规模预测需求。
在使用前,需要准备好目标分子的序列或结构信息。对于蛋白质和核酸,可以准备FASTA格式的序列文件;对于小分子配体,则需要相应的结构信息。测试数据可以从RCSB PDB数据库(https://www.rcsb.org)下载已解析的复合物结构作为参考,也可以使用用户自己的研究数据。平台每个账号每日最多支持20次预测任务,充分满足大多数科研需求。
3.2 任务配置与提交
任务配置过程直观易懂。在任务界面中,用户需要逐一添加分子组分,包括蛋白质、核酸、小分子、离子等。每添加一个分子,填写对应的序列或结构信息。例如,预测蛋白质-RNA复合物时,需要分别添加蛋白质的氨基酸序列和RNA的核苷酸序列。系统支持多种分子类型的组合,几乎覆盖所有常见的生物分子复合物场景。
完成所有组分的添加和参数设置后,点击”启动结构预测”按钮提交任务。系统会开始处理请求,根据复合物复杂程度和服务器负载,预测时间可能从几分钟到几十分钟不等。用户可以在任务列表中查看预测状态,完成后会通过界面通知和可视化结果展示。
3.3 结果解读与分析
AlphaFold 3提供丰富的结构可视化和多种置信度指标帮助用户评估预测质量。预测完成后,系统会显示结构的3D模型,其中不同区域的颜色代表预测置信度:蓝色表示高置信度,橙色表示低置信度。关键置信度指标包括:
- pLDDT:每个原子的置信度评分(0-100),数值越高表示置信度越高
- PAE:估计结构中两个标记之间相对位置的预测误差
- pTM与ipTM:分别衡量整体结构和界面区域的准确性
用户可以根据这些指标判断预测结果的可靠性,重点关注高置信度区域的结构特征。结果可以下载.cif格式的结构文件,使用PyMOL、ChimeraX等专业软件进行进一步分析和展示。
4 AlphaFold 3的官方地址和获取方式
4.1 在线平台访问
AlphaFold 3的主要服务入口是AlphaFold Server在线平台,官方网址为:https://alphafoldserver.com。该平台于2024年5月随AlphaFold 3的发布一同推出,旨在为全球科研人员提供免费、易用的非商业研究工具。平台界面设计人性化,无需编程或机器学习专业知识即可操作,大大降低了使用门槛。
访问平台需要使用Google账号登录,登录后点击左上角的”Server”即可进入任务管理界面。平台对非商业研究用途免费开放,但设有每日20次预测的使用限制,这一限制已从最初的10次提升至当前额度,能满足大多数科研团队日常需求。
4.2 本地部署选项
对于有特殊需求的研究机构,AlphaFold 3也提供本地部署方案。2024年11月11日,Google DeepMind已正式开源AlphaFold 3模型权重,研究人员可以从官方GitHub仓库获取完整代码和模型参数,在自有计算环境中部署运行。
本地部署需要相应的技术支持和计算资源,但提供了更大的灵活性和定制空间。开源地址为:https://gitcode.com/gh_mirrors/alp/alphafold3,社区也提供了多种镜像和简化部署方案,帮助研究人员快速上手。本地部署版本特别适合处理敏感数据或需要大规模预测任务的研究团队。
5 AlphaFold 3 vs 同类型竞品对比分析
5.1 技术优势对比
与传统分子对接方法和专门化预测工具相比,AlphaFold 3展现出全面的技术优势。下面的对比表格清晰展示了AlphaFold 3与主要竞品在不同维度上的差异:
| 对比维度 | AlphaFold 3 | 传统对接方法 | 专门化预测工具 |
|---|---|---|---|
| 预测范围 | 蛋白质、DNA、RNA、配体等几乎所有生物分子 | 通常限于特定分子类型 | 专注于单一分子类型或相互作用 |
| 预测精度 | 比传统方法提高50%-100% | 基准水平 | 因工具而异,通常优于传统方法但范围有限 |
| 使用便捷性 | 在线平台+开源代码,无需专业背景 | 需要专业知识和参数调整 | 通常需要专业知识 |
| 计算效率 | 几分钟至几十分钟完成预测 | 可能需数小时至数天 | 计算时间因任务复杂度而异 |
| 动态信息 | 主要预测静态结构,有限动态信息 | 可提供部分动态信息但精度有限 | 部分工具可提供动态模拟 |
AlphaFold 3的独特优势在于其通用性和精度的完美结合。它不仅是第一个在生物分子结构预测上超越物理模型的AI系统,而且是首个能够全面计算整个分子复合体的单一模型,避免了专门化工具需要多次预测和手动组装的繁琐过程。
5.2 应用场景对比
在不同应用场景下,AlphaFold 3也展现出显著优势。在药物研发领域,AlphaFold 3能够准确预测小分子药物与靶蛋白的结合模式,成功率大幅超越传统分子对接方法;在基础生物学研究中,其多分子预测能力为理解转录调控、信号转导等复杂过程提供全新工具;在工业酶设计方面,AlphaFold 3可预测酶蛋白的活性位点结构,指导理性设计。
与Rosetta、AutoDock等传统工具相比,AlphaFold 3的最大突破在于减少了对先验知识的依赖。传统方法通常需要目标结构信息作为输入,而AlphaFold 3仅凭序列信息就能实现高精度预测,这在研究全新靶点时具有无可替代的价值。然而,AlphaFold 3目前主要提供静态结构预测,在分子动力学模拟方面尚有局限,与传统模拟方法形成互补而非完全替代关系。
6 AlphaFold 3的典型应用场景与实际体验
6.1 药物研发与设计
AlphaFold 3在药物研发领域展现出巨大价值,能够显著加速先导化合物的筛选和优化过程。实际案例显示,某生物制药公司在开发新型抗肿瘤药物时,面临靶点蛋白结构未知的困境。传统实验方法需要数月时间才能获得初步结构信息,而使用AlphaFold 3,团队在几天内就获得了高质量的预测结构,并基于此设计了具有高选择性的抑制剂分子。
在实际体验中,研究人员特别赞赏AlphaFold 3在预测抗体-抗原复合物方面的能力。抗体药物开发的关键在于理解抗体与靶向蛋白的结合模式,AlphaFold 3能够提供高精度的结合界面预测,帮助研究人员优化抗体亲和力与特异性。一位使用者表示:”AlphaFold 3让我们能够快速评估不同抗体变体的结合特性,将原本需要数周的实验周期缩短到几天”。
6.2 基础科学研究
在基础科学研究中,AlphaFold 3正改变着科学家的工作方式。结构生物学家传统上需要花费大量精力进行模型搭建,尤其在晶体时代,由于方法限制,并非所有衍射数据都能获得蛋白质结构,往往需要相对正确的模板。AlphaFold 3完全解决了这个问题,将科研工作者从繁重的模型搭建工作中解放出来,从源头减少了模型搭建错误的产生。
一位结构生物学研究者分享体验:”自从AlphaFold 3诞生以来,由于缺少模板无法求解的晶体结构变得凤毛麟角。我们现在可以更专注于生物学问题的本质,而不是技术细节。”特别是在研究膜蛋白、大型蛋白复合物等难以通过实验方法解析的复杂体系时,AlphaFold 3提供了前所未有的研究工具,推动结构生物学进入”预测优先”的新范式。
6.3 农业与环境科学
AlphaFold 3在农业生物技术领域也展现出应用潜力。实际案例显示,研究人员利用AlphaFold 3预测植物病原菌效应蛋白的结构,揭示了其与宿主植物免疫蛋白的相互作用机制。这一发现为开发抗病作物品种提供了重要的分子基础,有助于减少农药使用和提高作物产量。
在环境科学方面,AlphaFold 3可用于研究污染物降解酶的结构与功能,指导设计更高效的生物修复策略。通过预测酶蛋白的活性位点结构,研究人员能够理性设计具有更高催化效率或新型功能的酶制剂,用于环境污染物治理。这种基于结构的设计方法,相比传统的随机突变筛选,具有更高的成功率和更短的开发周期。
7 AlphaFold 3能为用户带来的价值
7.1 研究效率的飞跃提升
AlphaFold 3为用户带来的最直接价值是研究效率的质的飞跃。传统实验方法确定一个蛋白质复合体的结构可能需要数年的X射线晶体学或冷冻电镜实验,消耗一个博士生整个求学生涯,而AlphaFold 3将这一过程缩短到几分钟到几十分钟。这种速度优势使研究人员能够快速验证科学假设,加速研究迭代周期。
更为重要的是,AlphaFold 3简化了研究工作流程。过去,结构生物学家和药物设计工程师需要耗费很大精力获得高分辨率结构后才能进行实验设计和验证。现在,这个最耗时的过程可以省略或绕过,研究人员可以直接基于预测结构进行实验设计、机理阐释和药物开发,从根本上改变了工作流程。
7.2 科学洞察的深度拓展
除了效率提升,AlphaFold 3还为用户带来了更深层次的科学洞察能力。传统结构生物学方法只能提供孤立的”分子快照”,而AlphaFold 3能够预测分子复合物的完整结构,揭示蛋白质、DNA、RNA、小分子等如何组装成功能性分子机器。
这种能力使研究人员能够从”观察单个零件”升级到”理解整个机器”,为理解生命过程的分子机制提供全新视角。例如,通过预测转录因子与DNA的复合物结构,科学家可以更深入理解基因表达的调控机制;通过模拟药物分子与靶蛋白的结合模式,研究人员可以理性设计更有效的治疗策略。
8 AlphaFold 3最近3到6个月内的重大更新与动态
8.1 开源计划实施与技术改进
在最近的更新中,最引人注目的是AlphaFold 3模型的开源计划全面实施。根据计划,Google DeepMind于2024年11月11日正式开源了AlphaFold 3模型权重,使全球研究人员能够在本地环境中部署和运行这一先进工具。开源内容包括完整的模型参数、推理代码和详细文档,支持学术机构和研究团队进行更深入的研究和定制化开发。
同时,DeepMind团队持续优化模型性能,解决了早期版本中存在的一些技术局限。例如,针对模型输出有时违反手性规则的问题,通过改进训练策略和损失函数,提升了立体化学的准确性;针对原子碰撞问题,优化了空间约束处理机制。这些改进使AlphaFold 3的预测结果更加可靠和实用。
8.2 服务器平台功能扩展
AlphaFold Server平台也进行了重要更新。最显著的改进是将每日免费预测次数从10次提升到20次,扩大了非商业研究的支持范围。平台还优化了用户界面,增强了结果可视化功能,提供了更丰富的置信度指标和交互式分析工具。
此外,平台扩展了支持的分子修饰类型,目前包括23种蛋白质修饰和15种RNA修饰,更好地模拟真实生物环境中分子的化学状态。对于特殊分子类型的支持也在持续改进,如对非标准氨基酸、金属配位复合物等的处理能力得到增强。
9 常见问题FAQ解答
Q1:AlphaFold 3是免费使用的吗?
A:是的,AlphaFold 3通过AlphaFold Server平台为全球科学家提供免费的非商业研究服务。每个账号每日可进行20次预测任务。对于商业用途,需要与Isomorphic Labs合作并遵循相应的商业条款。
Q2:使用AlphaFold 3需要具备哪些专业知识?
A:基本使用不需要专业的机器学习或编程知识,通过网页界面即可完成预测。但理解生物分子结构和药物设计的基础知识将有助于更好地利用该工具,正确解读预测结果。
Q3:AlphaFold 3的预测结果可靠吗?
A:AlphaFold 3的预测准确性在多个基准测试中超越了传统方法,特别是在蛋白质与其他分子的相互作用预测上比现有技术提高50%以上。但用户应结合提供的置信度指标(如pLDDT、PAE)评估具体预测的可靠性,高置信度区域的结果通常更为可靠。
Q4:AlphaFold 3可以预测动态的分子构象变化吗?
A:目前AlphaFold 3主要预测生物分子系统的静态结构,而不是在溶液中的动态行为。对于构象变化的研究,仍需结合分子动力学模拟等传统方法。动态预测是未来发展的重要方向。
Q5:如何处理预测结果中的低置信度区域?
A:低置信度区域(通常显示为橙色或红色)可能需要谨慎对待。这些区域可能对应结构中的柔性部分或缺乏足够进化约束的区域。建议结合实验数据或其他计算方法进行进一步验证。
10 总结
AlphaFold 3代表了人工智能在科学研究中应用的里程碑,它不仅延续了AlphaFold系列在蛋白质结构预测方面的卓越表现,更将能力扩展到了几乎所有的生命分子类型。通过创新的扩散模型架构和简化的Pairformer设计,AlphaFold 3在预测精度、速度和通用性方面实现了全面突破,为生物医学研究提供了前所未有的工具支持。
从实际应用来看,AlphaFold 3正在重塑生物医学研究的基本范式。它使研究人员能够从孤立研究单个分子转向全面理解分子复合物的结构与功能,为药物设计、酶工程、基础生物学研究等领域注入了全新动能。虽然目前在动态预测等方面仍有局限,但其展现的潜力已经令人惊叹。
随着开源计划的实施和服务器平台的持续优化,AlphaFold 3的影响力将进一步扩大。未来,我们有理由期待这一技术将继续推动生命科学研究的变革,加速科学发现向实际应用的转化,最终为人类健康和疾病治疗带来深远影响。
参考文章或数据来源
本文综合参考了以下权威信息来源,确保了内容的准确性和时效性:
- 《AlphaFold 3_百度百科》- 百度百科
- 《AlphaFold 3:蛋白质结构预测的技术革命与应用前景》- CSDN博客
- 《【前沿进展】谷歌发布AlphaFold 3.0 颠覆生物医学研究》- 澎湃新闻
- 《AlphaFold-快懂百科》- 快懂百科
- 《人类将会永生?谷歌 DeepMind重磅发布Alphafold 3》- InfoQ写作社区
- 《最新发布的AlphaFold 3有多厉害?我们请使用者聊了聊》- 36氪
- 《谷歌DeepMind的AlphaFold3重大突破》- 至顶科技
- 《AlphaFold 3:革命性的AI生物分子预测工具 – 使用教程与科学探索》- 站长之家
- 《【AI医疗】AlphaFold 3深度剖析》- 微信公众平台
- 《AlphaFold3(AF3)使用指南 – 简书》- 简书
引用总结:本文引用了百度百科、CSDN、澎湃新闻、InfoQ、36氪等多个平台的内容,数据来自谷歌DeepMind官方发布、学术期刊《自然》以及实际用户反馈,确保了文章的专业性和可靠性。
数据统计
更多AI产品信息
AlphaFold3
已有 35 次访问体验
已收录
申请修改
AlphaFold3的官网地址是?
AlphaFold3的官网及网页版入口是:https://alphafoldserver.com/welcome 官网入口👈
网站流量数据说明
网站数据仅供参考。评估因素包括访问速度、搜索引擎收录、用户体验等。 如需获取详细数据(如IP、PV、跳出率等),请联系站长获取。
推荐数据源
爱站/AITDK
关于AlphaFold3的特别声明
AI产品库AIProductHub是一个专注于AI产品收录与分享的网站平台,平台收录了1000余款AI产品,覆盖创作、办公、编程、视频生成、电商、设计、写作、图像生成等多个领域和行业,平台旨在帮助更多的用户发现更好用的AI产品。本站【AI产品库AIProductHub】提供的【AlphaFold3】信息来源于网络。 对于该外部链接的指向,不由【AI产品库AIProductHub】实际控制。【AlphaFold3】在【2026-01-31 23:34】收录时, 该网页内容属于合规合法,后期如出现违规内容,可直接联系网站管理员删除,【AI产品库AIProductHub】不承担任何责任。
本文地址:https://aiproducthub.cn/sites/alphafold3.html 转载请注明来源
相关导航

NVIDIA BioNeMo是专为生物制药行业打造的生成式AI平台,通过加速药物研发工作流,显著降低新药发现成本与时间。

新HepAI
HepAI是中科院高能所开发的专为高能物理、粒子天体物理等科学研究领域打造的AI平台,提供从数据加工、算力支持到智能应用的一站式解决方案。

新AMiner
AMiner是清华大学开发的AI科研助手,基于GLM大模型,实现文献检索、阅读和写作的一站式智能辅助。

新智能化工大模型
智能化工大模型是化工行业专用AI大模型,通过虚拟工厂和数字孪生技术大幅缩短研发周期。

新衍因科技
衍因智研云是AI驱动的生物医药数字化科研协作平台,通过智能体技术重构研发全流程,提升效率5-10倍。
新“赛博士”(Dr. Sai)
赛博士是国际高能物理领域首个大型AI科研智能体,能自动化完成从数据分析和程序编写到论文撰写的全流程科研任务。

新Oracle Life Sciences AI Data Platform
Oracle生命科学AI数据平台通过统一数据管理和AI分析,加速临床研究并提升药物安全监测效率。

新百图生科
百图生科是一款基于AI大模型的生命科学研发平台,旨在通过生物计算技术加速药物发现、抗体设计等流程。

暂无评论...